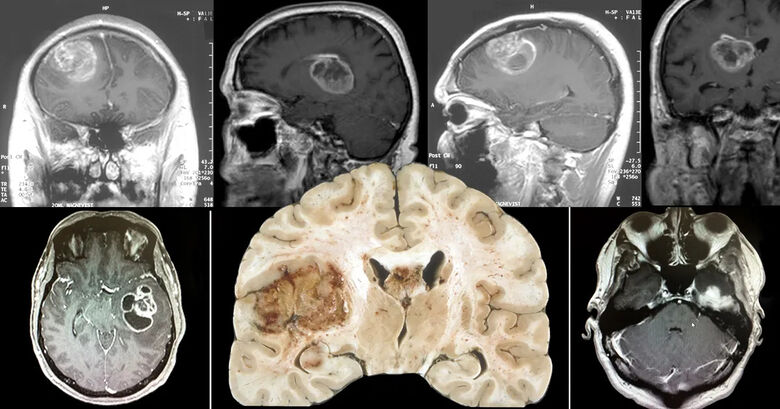
 Glioblastoma - Fotomontagem: Jornal da USP - Crédito: Flickr e Wikimedia Commons
Glioblastoma - Fotomontagem: Jornal da USP - Crédito: Flickr e Wikimedia CommonsGlioblastomas são tumores agressivos e muito incidentes — eles representam 15% de todos os cânceres cerebrais e estão entre os 12 tumores mais frequentes no Brasil. Caracterizam-se por uma rápida infiltração no tecido cerebral e são rotineiramente tratados com radiação ionizante — técnica mais conhecida como radioterapia, em que feixes de radiação incidem sobre o tumor do paciente, danificando o DNA das células tumorais, levando-as à instabilidade e morte.
Devido à frequente aquisição de resistência a estas terapias e à escassez de novos tratamentos, esse tumor tem um prognóstico muito ruim: apenas um em cada dez pacientes sobrevive mais de cinco anos após o diagnóstico inicial.
Com o intuito de desvendar a relação entre proteínas envolvidas no reparo de DNA e na resistência tumoral, pesquisadores do Instituto de Química (IQ) da USP realizaram um estudo com uso de modelos celulares de glioblastoma humano resistente à radioterapia. Foi utilizado o cultivo celular tradicional em uma placa (duas dimensões) e em culturas de esferóides — pequenas esferas de células (três dimensões) que se assemelham a tumores sólidos. Os resultados dos experimentos mostraram, pela primeira vez, uma interdependência entre as duas vias de proteínas – espécie de caminho molecular que elas percorrem na célula – e sua atuação conjunta na regulação do reparo de DNA lesionado pela radioterapia.
Já é sabido que uma das principais responsáveis pela radioresistência é a proteína supressora de tumor p53. Em condições normais, a p53 desempenha um papel central na resposta celular, permitindo o reparo do dano no DNA, ou a indução da morte celular (benéfica ao organismo em certas condições, como quando as células sofrem mutações). Em 50% dos pacientes portadores de glioblastoma, a p53 encontra-se alterada, o que prejudica a sua função de suprimir a proliferação e a sobrevivência dos tumores e de manter a integridade do genoma celular.
Outro conjunto de proteínas importante é o das Rho GTPases, que são responsáveis por regular a proliferação e diferenciação celular, a dinâmica do citoesqueleto de actina (responsável por manter o formato e a integridade celular, sua mobilidade e a invasividade de outros tecidos, além de transportar proteínas para diferentes regiões e organelas) e a motilidade celular. Desse modo, não é incomum encontrar essas proteínas, bem como a sinalização que elas regulam, alteradas nesses tumores, o que possibilita o desenvolvimento e a capacidade invasiva dos glioblastomas.

Proteína supressora de tumor P53 e DNA em laranja - Foto: Wikimedia Commons
Para os experimentos, os cientistas separaram as culturas de células em dois grupos — um com p53 normal (selvagem) e outro com p53 mutante — e submeteram cada um deles a interferências em diferentes proteínas integrantes da via das Rho GTPases. Os resultados dos experimentos mostraram, pela primeira vez, uma interdependência entre as duas vias, da p53 e das Rho GTPases, e sua atuação conjunta na modulação do reparo de DNA lesionado pela radioterapia.
 Radioterapia - Foto: Flickr
Radioterapia - Foto: Flickr
No caso das células de glioblastoma com p53 normal e funcional, todas as interferências na via Rho reverteram — em maior ou menor grau, a depender da proteína-alvo modificada — a resistência tumoral, de modo que a radioterapia voltou a ser uma opção eficaz de tratamento para a doença. Porém, nas células de glioblastoma com p53 mutante, nenhuma das alterações realizadas na via Rho foi capaz de reverter a resistência tumoral à terapia com radiação ionizante.
Para contornar este problema, os pesquisadores utilizaram uma droga que reativa a proteína p53 mutante e restabelece muitas de suas funções normais. Quando utilizada em conjunto com os diferentes métodos de inibição da via Rho, foi possível reverter também a resistência das células tumorais com p53 mutante frente à terapia com radiação ionizante.
Segundo Yuli Magalhães, primeira autora do artigo Downregulation of the Rho GTPase pathway abrogates resistance to ionizing radiation in wild-type p53 glioblastoma by suppressing DNA repair mechanisms, a chave para explicar este mecanismo está na atuação da p53 selvagem e na regulação da dinâmica do citoesqueleto de actina. Quando a via Rho atua normalmente, ela controla o processo de polimerização dos filamentos de actina que compõem o citoesqueleto celular. Essa polimerização acontece através da ligação sequencial de pequenas moléculas de actina (os monômeros) para a formação de uma estrutura longa e resistente (o filamento). Porém, se a polimerização é comprometida e os filamentos não são formados, os monômeros são liberados no citoplasma da célula. Livres, eles são capazes de se ligar à proteína p53 selvagem, conduzindo-a ao núcleo celular — onde ela pode atuar no DNA, regulando a sinalização, o reparo do genoma e até mesmo a morte das células tumorais, especialmente após o tratamento com radiação ionizante.

Yuli Magalhães - Foto: Arquivo Pessoal

Fabio Forti - Foto: Arquivo Pessoal
Fabio Forti, docente do IQ e responsável por orientar a pesquisa, explica qual é a importância desta descoberta para a prática clínica. Embora o mecanismo revelado não seja ativo em glioblastomas com p53 mutante, que são a maioria dos casos conhecidos hoje, existem opções farmacológicas disponíveis no mercado para reativação da p53 em diferentes tipos de tumores — ou seja, medicamentos que fazem com que a proteína se comporte similarmente ao seu estado selvagem nas células cancerosas. Assim, as terapias combinadas — com uso de drogas que reativam p53 e outras que inativam a via das Rho GTPases — serão eficazes em reverter a resistência e ampliar a sensibilidade do tumor à radiação ionizante, com consequente morte celular e acelerada regressão tumoral.
Para os próximos passos da pesquisa, Yuli Magalhães conta que o foco de seu pós-doutorado será avaliar a aplicabilidade dos resultados encontrados em modelos animais, a fim de verificar a eficácia do mecanismo proposto em um modelo vivo e mais complexo. Com isso, espera-se expandir as descobertas para uma futura aplicação clínica, que possa levar a uma sobrevida maior e com mais qualidade aos pacientes acometidos pelo glioblastoma.
Mais informações: e-mail [email protected], com Yuli Magalhães; e-mail [email protected], com Fabio Forti
*Da Assessoria de Comunicação do Instituto de Química, editado por Fabiana Mariz
Estagiária sob orientação de Moisés Dorado
Deixe seu Comentário
Leia Também

Saúde
Projeto melhora atendimento de pacientes cardiológicos do SUS
28/04/2024 16:30

Saúde
Comissão aprova atendimento psicológico gratuito a enfermeiros do sistema público de saúde
28/04/2024 06:30
Saúde
Boletim InfoGripe diz que VSR supera covid-19 em mortes de crianças
27/04/2024 22:12

Saúde
Pediatras dão dicas de como evitar quedas de crianças
27/04/2024 15:30

Saúde
Casos de bronquiolite em bebês aumentam no estado do Rio de Janeiro
27/04/2024 14:00

